 A composição da matéria - ou seja, de tudo o que nos rodeia - faz parte da quantidade de mistérios a que a Humanidade sempre tentou responder.
A composição da matéria - ou seja, de tudo o que nos rodeia - faz parte da quantidade de mistérios a que a Humanidade sempre tentou responder.
O primeiro a investigar mais meticulosamente esta área foi o grego Demócrito de Abdera (460 a.C - 370 a.C) .
Na altura, já vários filósofos afirmavam que a matéria era divisível em porções cada vez menores.
Mas Demócrito teorizou que a matéria é constituída por pequenas e indivisíveis partículas.
Segundo o filósofo a matéria poder-se-ia dividir em porções sucessivamente menores, mas esta divisão teria um limite - o corpúsculo ou partícula indivisível.
Esta é a Teoria Corpuscular da Matéria.
De acordo com a Teoria Corpuscular da Matéria:
1) A matéria é constituída por pequenos corpúsculos.
2) Os corpúsculos estão em constante movimento
3) Entre os corpúsculos existem espaços vazios.
Assim, a Teoria Corpuscular da Matéria explica a dissolução de tinta de escrever na água porque os espaços vazios entre os corpúsculos da água são preenchidos pelos da tinta e vice-versa.

Explicação dos Estados Físicos da Matéria em Termos de Agregação Corpuscular
Os estados físicos da matéria (sólido, líquido e gasoso) são explicados pelo estabelecimento de forças que ,mantêm os corpúsculos mais ou menos unidos, condicionando a sua organização e liberdade de movimento.
No entanto, se as condições de temperatura e / ou pressão forem alteradas o estado físico poderá também ser alterado.
Os Estados Físicos da Matéria
Estado Sólido
Propriedades Macroscópicas
- Forma Própria
- Volume constante (a temperatura constante)
- Difícil de comprimir
A nível de agregação corpuscular
- Os corpúsculos encontram-se muito próximos e organizados
- As forças de ligação entre eles são fortes
- A sua liberdade de movimento é pequena
- Os corpúsculos movem-se apenas em torno das suas posições
Estado Líquido
Propriedades Macroscópicas
- Forma Variável
- Volume constante (a temperatura constante)
- Difícil de comprimir
A nível de agregação corpuscular
- Os corpúsculos encontram-se mais afastados do que nos sólidos
- Dispõem-se desordenadamente
- As forças de ligação entre eles são mais fracas do que nos sólidos
- Movem-se mais livremente
Estado Gasoso
Propriedades Macroscópicas
A nível de agregação corpuscular
- Os corpúsculos encontram-se muito mais afastados uns dos outros
- As forças de ligação entre eles são fracas
- Movem-se rápida e desordenadamente
- O seu movimento é praticamente livre.
Por que é que os estado físico muda com a mudança de temperatura
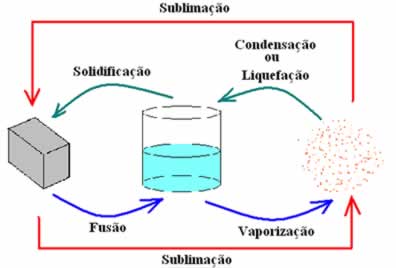
Quando se aquece um material, o nível de agitação dos seus corpúsculos aumenta, estes passam a ter maior liberdade de movimento, as suas forças de ligação tornam-se mais fracas e o seu grau de organização passa ser menor.
Assim, através do aquecimento de um sólido podemos obter um líquido, ou de um líquido um gás, ou mesmo de um sólido um gás.
Por outro lado, quando se arrefece um material, o nível de agitação dos seus corpúsculos diminui, estes passam a juntar-se e a ter menor liberdade de movimento, as suas ligações tornam-se mais fortes e os seu grau de organização aumenta.
Podemos assim, através do arrefecimento de um gás obter um líquido, ou de um líquido obter um sólido, ou obter este através do arrefecimento por sublimação de gás.
Átomos
Demócrito ao referir que a matéria era composta por pequeníssimos corpúsculos, chamou-lhes átomos, que em grego antigo significaria "indivisíveis" .
Mas depois de Demócrito a Teoria Corpuscular foi abandonada até ao século XVIII com o químico inglês John Dalton (1766-1844).
Dalton afirmou que os átomos poder-se-iam juntar formulando moléculas.
E assim ficou definido que:
- Os átomos são pequeníssimos corpúsculos constituintes da matéria.
- Que estes podem agrupar-se em moléculas.
- Os átomos e as moléculas são as unidades estruturais da matéria.
- Estes são ínfimos e inobserváveis ao olho humano.
Ainda, podemos identificar os átomos como sendo:
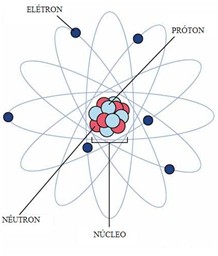
" uma unidade da matéria, a unidade mais pequena de um elemento tendo todas as características do referido elemento e que consiste de um núcleo central, denso, carregado positivamente por um sistema de electrões.
 Toda a estrutura têm aproximadamente um diâmetro de 10 elevado a -8 centímetros e caracteristicamente permanece indivisível em reacções químicas excepto para remoções limitadas, transferências ou trocas de electrões.
Toda a estrutura têm aproximadamente um diâmetro de 10 elevado a -8 centímetros e caracteristicamente permanece indivisível em reacções químicas excepto para remoções limitadas, transferências ou trocas de electrões.
Os átomos e as moléculas são hoje em dia observáveis através de várias técnicas como a microscopia electrónica.
 Toda a estrutura têm aproximadamente um diâmetro de 10 elevado a -8 centímetros e caracteristicamente permanece indivisível em reacções químicas excepto para remoções limitadas, transferências ou trocas de electrões.
Toda a estrutura têm aproximadamente um diâmetro de 10 elevado a -8 centímetros e caracteristicamente permanece indivisível em reacções químicas excepto para remoções limitadas, transferências ou trocas de electrões.
É considerado uma unidade da fonte de energia nuclear."
- The free Dictonary by Farlex - traduzido
Os núcleos dos átomos são constituídos por protões, partículas com carga eléctrica positiva e neutrões, com carga eléctrica neutra.
Em redor do núcleo giram electrões, com carga eléctrica negativa, não tendo uma órbita ocupando posições aleatórias em redor do núcleo.
Moléculas
As moléculas podem ser constituídas por diferentes átomos e têm o nome de diatómicas se forem formadas por dois átomos, triatómicas se forem formadas por três, tratatómicas por quatro.
Elementos
Os elementos são substâncias compostas por átomos que têm um número idêntico de protões em cada núcleo. Os elementos não podem ser reduzidos a substâncias mais simples por meios químicos naturais ou regulares.
Estes estão organizados na tabela periódica que têm actualmente 116 elementos.
Estes estão organizados na tabela periódica que têm actualmente 116 elementos.
Substâncias Elementares e Compostas
Dá-se o nome de substância elementar a todas as substâncias formadas por átomos de um só elemento ou moléculas com um só tipo de elemento.
Existem substâncias elementares cujas moléculas são formadas pelo mesmo tipo de átomos mas, no entanto, são moléculas diferentes. A estas substâncias dá-se o nome de formas alotrópicas.
O oxigénio (O2) e o ozono (O3) são exemplos de formas alotrópicas.
O diamante e o grafite são substâncias constituídas por átomos de carbono. Porém os átomos não se encontram em agrupamentos moleculares, mas sim em estruturas gigantes, onde os átomos estão ordenados de forma contínua.
Símbolos e fórmulas químicas
Desde da Antiguidade que os alquimistas usam uma simbologia para representar os elementos químicos.
Dalton generalizaria, pela primeira vez em 1800 o uso de símbolos, porém, estes revelaram-se demasiado complicados e pouco práticos.
A simbologia ainda usada actualmente foi proposta pelo químico Berzelius em 1813.
Este propôs que os elementos fossem representados por uma, duas ou três letras, do nome do elemento em latim ou em inglês, sendo a primeira letra maiúscula e as restantes (se necessárias) minúsculas.
Um símbolo químico representa assim, nos dias de hoje, um elemento e um átomo desse elemento.
A leitura dos símbolos químicos faz-se lendo cada letra separadamente.
Alguns dos símbolos químicos mais importantes:
Hidrogénio - H
Oxigénio - O
Azoto (Nitrogénio) - N
Hélio - He
Lítio - Li
Carbono - C
Flúor - F
Sódio - Na
Magnésio - Mg
Cálcio - Ca
Enxofre (Súlfur) - S
Cloro - Cl
Ferro - Fe
Potássio - K
Fósforo - P
Alumínio - Al
Zinco - Zn
Cobre - Cu
Néon - Ne
Níquel - Ni
Iodo - I
Prata - Ag
Ouro - Au
Mercúrio - Hg
Fórmulas químicas
No caso das substâncias moleculares, a fórmula química indica-nos os elementos que constituem a substância - informação qualitativa - e o número de átomos de cada elemento que entram na constituição das moléculas dessa substância - informação quantitativa.
Escrita de fórmulas químicas:
H - 1 átomo de hidrogénio
2H - 2 átomos de hidrogénio separados
H2 - 1 molécula de hidrogénio formada por 2 átomos de hidrogénio ligados entre si.
2H2 - 2 moléculas de hidrogénio cada uma formada por 2 átomos ligados entre si. No total há 4 átomos de hidrogénio.
Podemos assim ter também, por exemplo:
 Metano - CH4 - Um átomo do elemento carbono e quatro átomos do elemento hidrogénio
Metano - CH4 - Um átomo do elemento carbono e quatro átomos do elemento hidrogénioEtanol - C2H6O - Dois átomos do elemento carbono, seis átomos do elemento hidrogénio e um átomo do elemento oxigénio.
Iões
Fórmulas químicas de substâncias iónicas
Recursos externos acerca dos iões
Para compreender melhor a parte do estudo dos iões aconselho este slideshare e os seguintes vídeos:
Como já foi visto anteriormente os átomos possuem um núcleo que é constituído por protões e neutrões, orbitando em volta deste os electrões.
Se os átomos perderem um ou mais electrões ficam com excesso de cargas positivas relativamente ao número de cargas negativas. Formam-se, assim, iões com carga positiva, ou catiões.
Se os átomos ganharem um ou mais electrões ficam com excesso de cargas negativas relativamente ao número de cargas positivas. Formam-se, assim, iões com carga negativa, ou aniões.
Representação simbólica de iões
Os iões representam-se pelos símbolos químicos dos elementos que os constituem, indicando-se em expoente a carga.
Cl- - Anião de cloreto - 1 carga negativa - um átomo de cloreto
NH4+ - Catião - Amónio - 1 carga positiva - um átomo de azoto e quatro átomos de hidrogénio
PO43- Anião - Fosfato - 1 átomo de fósforo e quatro átomos de hidrogénio.
Na escrita de fórmulas químicas temos que ter atenção a certos pormenores:
- Escreve-se primeiro o ião positivo e depois o ião negativo.
- O número de cargas positivas tem de ser igual ao número de cargas negativas, para que a soma de cargas dos iões seja nula.
Podemos definir o seguinte raciocínio para ser utilizado no cálculo das formas químicas:
- Qual será a fórmula química do cloreto de cobre(II)?
- O cloreto de cobre é constituído por iões de cobre (II) - Cu [em índice] 2+ - e por iões de cloreto, Cl-.
- Para que a soma das cargas dos iões seja igual a zero, é necessário que o número de iões Cl- seja duplo ao número de iões Cu 2 +.
- Realizamos a operação: (+2) + 2 x (-1) = 0.
- A fórmula química é, portanto, CuCl2.
Representação do estado físico da matéria numa fórmula química
A representação do estado físico da matéria numa fórmula química é feita através de letras que são postas depois um pouco abaixo da fórmula química.
(l) líquido (g) gasoso (s) sólido (sq) solução aquosa (c) cristalino
Leitura quantitativa e qualitativa
Nas fórmulas químicas e iónicas é possível fazer dois tipos de leitura: a quantitativa e a qualitativa.
Na leitura qualitativa: explicitamos apenas o número de átomos da substância, sem especificar o estado.
Já na leitura quantitativa não especificamos o números de átomos, apenas o nome da substância e o estado físico.
Recursos externos acerca dos iões
Para compreender melhor a parte do estudo dos iões aconselho este slideshare e os seguintes vídeos:






Sem comentários:
Enviar um comentário